
Elektroliza to reakcja rozkładu cząsteczki chemicznej zachodząca pod wpływem przyłożonego z zewnątrz napięcia elektrycznego. Elektrolizie towarzyszyć może dysocjacja elektrolityczna, transport jonów do elektrod lub wtórne przemiany jonów na elektrodach.
Elektroliza wody
Elektroliza wody to proces rozkładu cząsteczki wody pod wpływem prądu elektrycznego na wodór i tlen.
Proces elektrolizy zachodzi w układach zawierających substancje zdolne do jonizacji, czyli rozpadu na jony i zachodzi z wymuszoną wędrówką jonów do elektrod zanurzonych w substancji, po przyłożeniu do nich napięcia elektrycznego.
Elektroda naładowana ujemnie nazywana jest katodą, a elektroda naładowana dodatnio – anodą.
Zobacz również: Odwrócona osmoza
Każda z elektrod przyciąga do siebie jony o ładunku przeciwnym:
-do katody przemieszczają się dodatnio naładowane kationy
-do anody kierują się ujemnie naładowane aniony
Jony przekazują elektrodom swój ładunek i mogą wchodzić z nimi w reakcję chemiczną.
W reakcji tej powstają obojętne elektrycznie związki chemiczne lub pierwiastki.
Wędrujące przez substancję jony mogą ulegać reakcjom chemicznym z innymi jonami. Powstające w ten sposób substancje osadzają się na elektrodach lub wydzielają w postaci gazu.
Zobacz również: Filtr do wody
Elektroliza wody reakcje na katodzie i anodzie
reakcja katodowa (redukcja)
2H2O + 2eˉ → H2 + 2OHˉ
reakcja anodowa (utlenianie)
2H2O → O2 + 4H+ +4eˉ
Równanie elektrolizy wody
Elektroliza wody równanie sumaryczne:
2H2O → 2H2 + O2
Reakcja elektrolizy wody
Elektroliza wody reakcja przebiegająca na elektrodach powoduje powstanie produktów tego procesu w postaci pierwiastków gazowych:
-tlenu – na anodzie
-wodoru – na katodzie
Zobacz również: Dystrybutor wody
Schemat elektrolizy wody
Elektroliza wody schemat reakcji przedstawiamy poniżej:
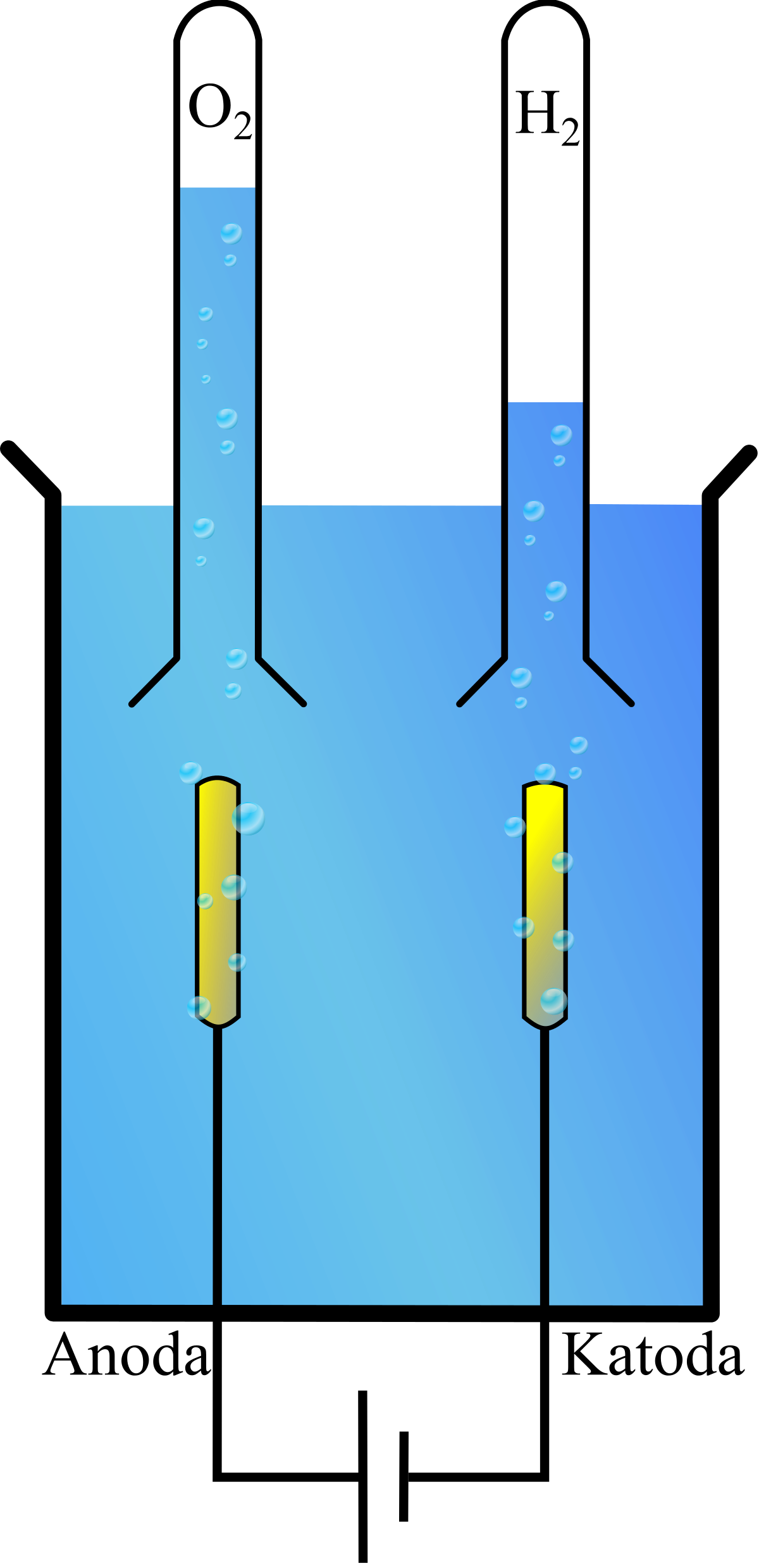
Doświadczenie elektrolizy wody
Elektroliza wody doświadczenie można przeprowadzić mając do dyspozycji:
-źródło prądu stałego, czyli akumulator lub prostownik przetwarzający prąd zmienny na stały
-elektrody
-woltomierz
-amperomierz
-opornik do regulowania różnicy potencjałów między elektrodami
Elektrody to przewodniki metaliczne zanurzone w roztworze elektrolitu i doprowadzające lub odprowadzające prąd elektryczny.
Wydajność procesu elektrolizy wody wydajność pozwala w prosty i stosunkowo tani sposób otrzymać czysty wodór i tlen na przemysłową skalę.
Elektroliza jest stosowana:
-przy produkcji niektórych metali: aluminium, litu, sodu, potasu
-przy produkcji substancji prostych i związków chemicznych
-do prowadzenia procesów utleniania i redukcji
-w procesie galwanizacji – do pokrywania metalu cienką warstwą innego metalu
Na skutek elektrolizy w urządzeniach zwanych jonizatorami powstaje zjonizowana woda alkaliczna, mająca właściwości zdrowotne.
Uważa się, że woda alkaliczna pomaga walczyć z cukrzycą, alergią, a nawet nowotworami, wspomagając system immunologiczny. Alkaliczne pH redukuje zakwaszenie organizmu i neutralizuje działanie wolnych rodników.
Podczas elektrolizy wody napięcie prądu powoduje rozpad cząsteczek wody na wodór i tlen.
Elektroliza wody destylowanej nie zachodzi. Proces elektrolizy dotyczy substancji rozpuszczonych w wodzie, więc w jonizatorze zachodzi elektroliza wody z solą rozpuszczoną w niej i cząsteczki rozkładają się dzięki przyłożeniu prądu stałego.
Wzór elektrolizy wody
Elektroliza wody wzór: H2O = H+ + OHˉ.
W jonizatorze katoda przyciąga dodatnie jony wodorowe do naczynia głównego, a anoda gromadzi jony ujemne w naczyniu wyjmowanym.
Jony dodatnie tworzą zjonizowaną wodę alkaliczną, w której znajdują się takie pierwiastki jak wapń, magnez czy potas.
Ujemne jony tworzą natomiast wodę kwaśną.
Zobacz również: Poidełko
Zobacz inne newsy:
31 sierpnia 2020
Urządzenie do gazowania wody
18 maja 2020
Poidełka wody pitnej
28 kwietnia 2020
Reduktor ciśnienia wody
17 kwietnia 2020
Zmiękczacz wody
7 kwietnia 2020
Odwrócona osmoza
6 kwietnia 2020




















